Šizofrēnijas neiroķīmiskais pamatojums
- Šizofrēnijas dopamīna teorija joprojām ir spēkā esoša neirobioloģiska teorija.1,2
- Dopamīna receptoriem, kas saistīti ar šizofrēnijas psihopatoloģiju, cilvēku smadzenēs ir atšķirīgs novietojums, afinitāte un īpašības.
- Tiek uzskatīts, ka mezolimbiskajā sistēmā dopamīnerģisko neironu hiperaktivitāte izraisa šizofrēnijas pozitīvos simptomus. Savukārt mezokortikālajā sistēmā dopamīnerģisko neironu hipoaktivitāte izraisa negatīvos un kognitīvos simptomus.
Šajā sadaļā
Dopamīna hipotēze
Sākotnēji šizofrēnijas dopamīna hipotēzes teorija balstījās uz netiešiem pierādījumiem, kuri tika iegūti klīniski novērojot pacientus, kuri tika ārstēti ar antipsihotiskajiem medikamentiem. Mūsdienās vizuālās diagnostikas pētījumi ļauj pārbaudīt un gūt tiem apstiprinājumu, sniedzot labāku priekšstatu par šizofrēnijas pamatā esošajiem patofizioloģiskajiem mehānismiem.3
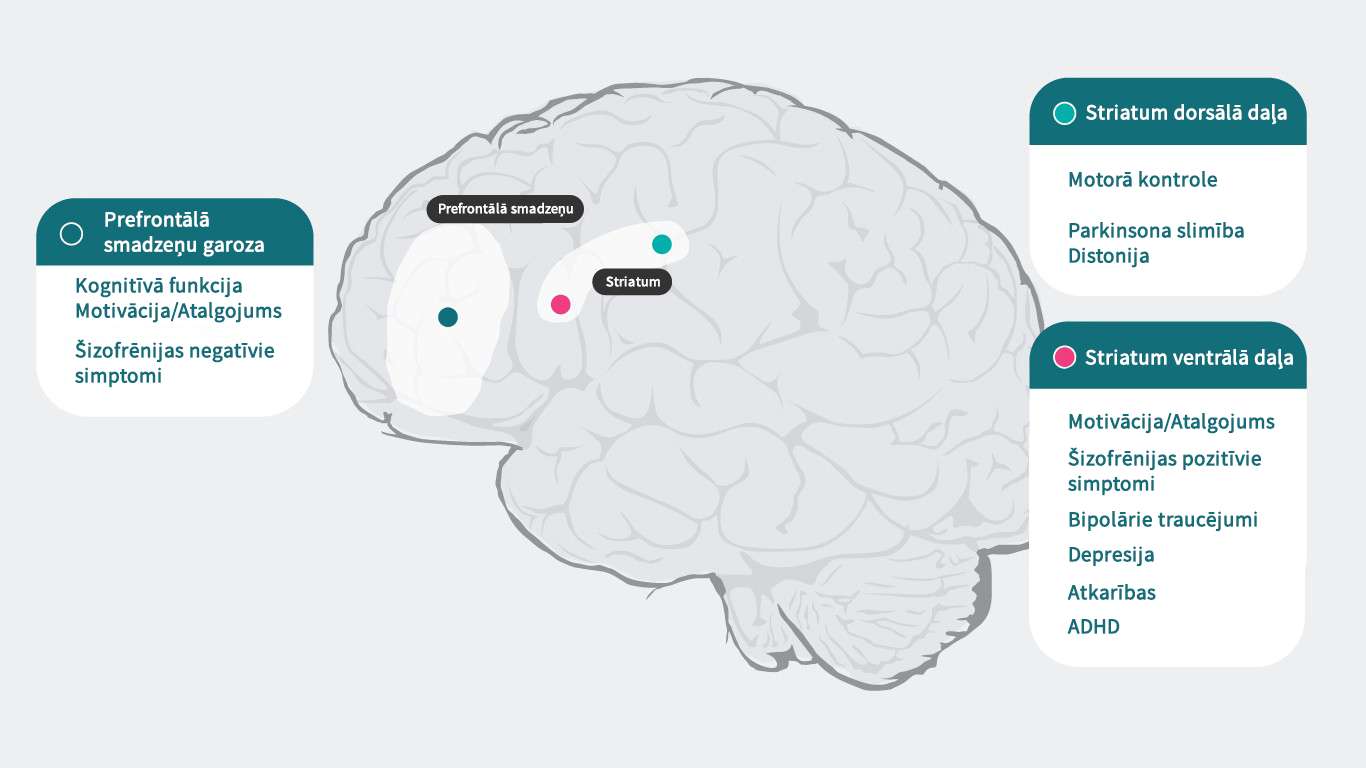
Dopamīns un smadzenes
Dopamīnam ir specifiska iedarbība katrā receptoru apakšgrupā, kas atbild par plašu psihisku un neiroloģisku funkciju loku (prefrontālā smadzeņu garoza: kognitīvā funkcija5, motivācija/atalgojums6–10, šizofrēnijas negatīvie simptomi11, Striatum dorsālā daļa: motorā kontrole12, Parkinsona slimība1, distonija1, Striatum ventrālā daļa: motivācija/atalgojums6–10, šizofrēnijas pozitīvie simptomi11,13, bipolārie traucējumi14, depresija8, atkarības15, UDHS16), tādēļ traucējumi šajos procesos var izraisīt virkni simptomu, kas saistīti ar psihisku slimību. Psihotropie medikamenti, kuri iedarbojas uz dopamīna receptoriem, var uzlabot šos simptomus. Tomēr nepieciešama laba izpratne par dopamīna darbību dažādos smadzeņu reģionos un šizofrēnijas pamatā esošajiem mehānismiem, lai pilnībā izvērtētu antipsihotisko medikamentu iedarbību uz dopamīna neirotransmisiju un to lomu šizofrēnijas ārstēšanā.4
Atsauces: Adaptēts no Stahl SM. Essential Pharmacology 4th edition 20131 ; Cools R, D’Esposito M. Biol Psychiatry. 2011;69(12):e113-125.5; Hamid AA, et al. Nat Neurosci. 2016;19(1):117-126.6; Koob GF, et al. NIDA Res Monogr. 1994;145:1–187; Biesdorf C, et al. Neurobiol Learn Mem. 2015;123:125-1398; Der-Avakian A, et al. Trends Neurosci. 2012 Jan;35(1):68-77.9; Leggio GM, et al. Eur Neuropsychopharmacol. 2008 Apr;18(4):271-7.10; Stahl SM. Prim Care Companion J Clin Psychiatry.2003;5(3)9-1311; Plowman EK, et al. J Parkinsons Dis. 2011;1(1):93-10012; Dichter GS, et al. J Neurodev Disord. 2012;4:19513; Ashok AH, et al. Mol Psychiatry.2017 May;22(5):666–67914; Orio L, et al. Addict Biol. 2010;15(3):312-32315; Volkow ND, et al. J Neurosci. 2012;32(3):841-84916.
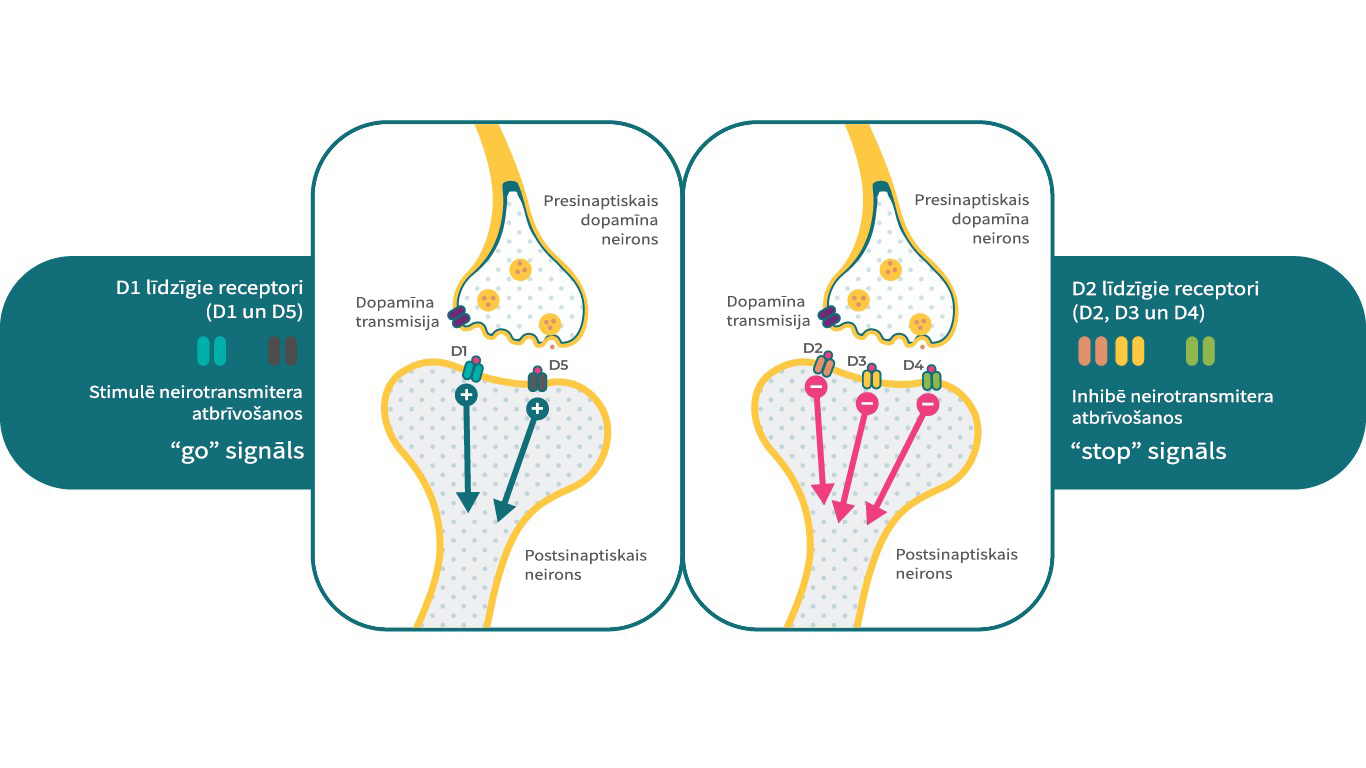
Dopamīna receptoru apakštipi
Pastāv 5 dopamīna receptoru apakštipi, kurus var iedalīt 2 galvenajās grupās. D1 līdzīgo receptoru grupa ietver D1 un D5 receptorus, bet D2 līdzīgo receptoru grupa ietver D2, D3, un D4 receptorus. No klīniskā viedokļa D2, D3 un D1 receptorus galvenokārt uzskata par saistītiem ar šizofrēnijas patofizioloģiju. Atkarībā no receptoru apakštipa, dopamīna receptori var reaģēt dažādi uz to pašu sekundāro signālu sistēmu – viens receptors var būt kā “stop” signāls, savukārt cita apakštipa receptori var būt kā pretējs signāls.4 Piemēram, D1 receptors var stimulēt cAMP, kamēr D2 un D3 receptori var inhibēt šo sekundāro signālu.
Tādējādi dopamīna klātbūtnē D1, D2, un D3 receptori var kalpot ļoti specifiskām, bet atšķirīgām neirobioloģiskām funkcijām, kas ļauj vienam neirotransmiteram kontrolēt dažādus psiholoģiskus, uzvedības un patoloģiskos stāvokļus.4,17
Atsauces: Adaptēts no Stahl, S. M. Dazzled by the dominions of dopamine: Clinical roles of D3, D2, and D1 receptors. CNS Spectr. 22, 305–311 (2017)4
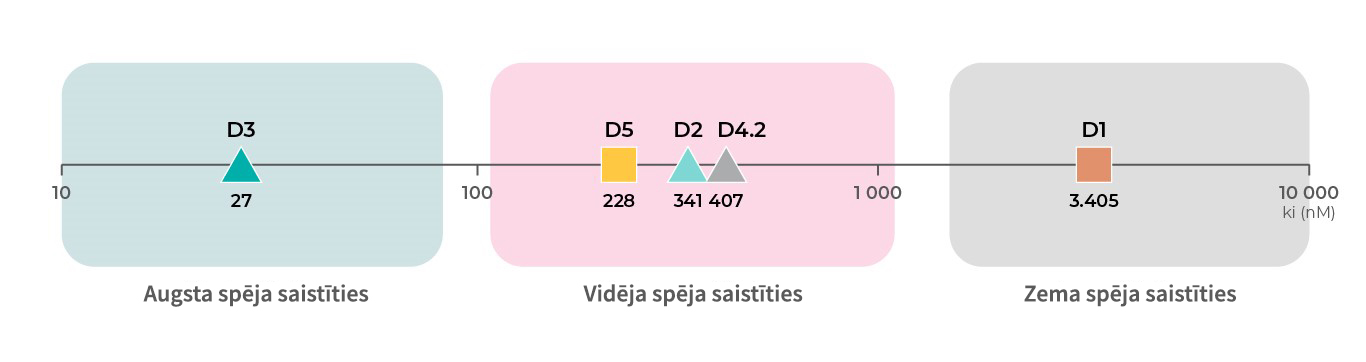
Dopamīna receptoru spēja piesaistīt dopamīnu
Papildus tam, ka dopamīna receptoriem ir atšķirīgas funkcijas, katram no dopamīna receptoru apakštipiem vēl ir arī atšķirīga spēja saistīties ar dopamīnu. Pamatojot ar atbilstošiem datiem no PDSP Ki datubāzes, D3 receptoriem19 ir augstākā spēja saistīties ar dopamīnu, tam seko D219,20, D421, un D518 receptori ar vidēju spēju, bet D118,19 receptoriem ir zemākā spēja piesaistīt dopamīnu.4
Atsauces: Visi dati par spēju saistīties ir no PDSP Ki datu bāzes
Saistīšanās spēja ar D1: Toll L, NIDA Res Monogr 1998, 178:44046619 ; Sunahara RK, Nature 1991, 350:614-61918
Saistīšanās spēja ar D2: Michaelides MR 1995, J Med Chem 38:3445-344720; Toll L, NIDA Res Monogr 1998, 178:44046619
Saistīšanās spēja ar D3: Toll L, NIDA Res Monogr 1998, 178:44046619; Cussac D, Naunyn Schmied Arch Pharmacol 2000, 361:569-572;
Saistīšanās spēja ar D4: Tallman JF, J Pharm Exp Ther 1997, 282:1011-101921;
Saistīšanās spēja ar D5: Sunahara RK, Nature 1991, 350:614-61918; Stahl SM, CNS Spect 2016, 21:123-12722.
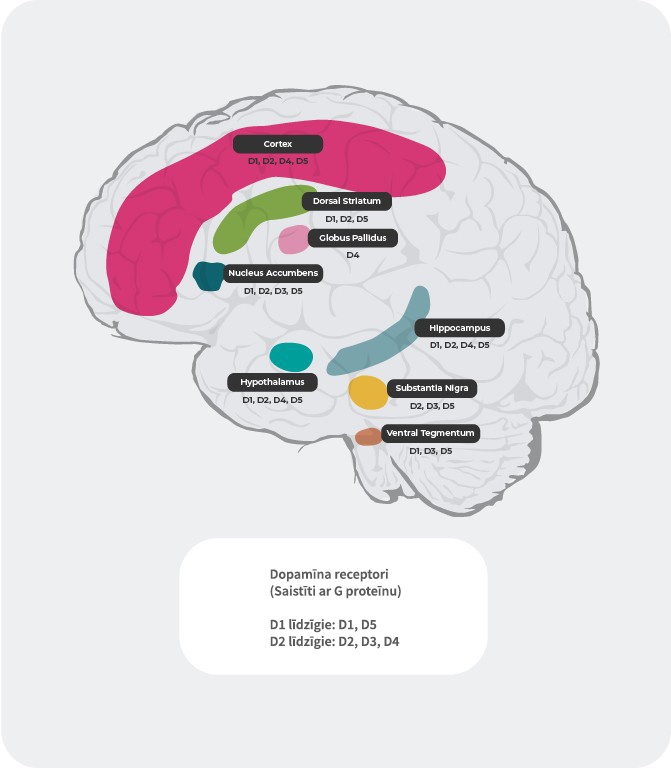
Dopamīna receptoru lokalizācija4,22-27
Papildus atšķirīgajām spējām piesaistīt dopamīnu, arī dopamīna receptoru lokalizācija smadzenēs atkarībā no to apakštipa atšķiras. Piemēram, pārmērīga dopamīna atbrīvošanās D2 postsinaptiskajos receptoros striatum ventrālajā daļā izraisa pozitīvos simptomus. Tādēļ lielākajai daļai šizofrēnijas ārstēšanai paredzēto antipsihotisko medikamentu dopamīna D2 receptori ir galvenais mērķis. D3 receptoru ekspresija ir izteiktāka limbiskajā sistēmā, hipotalāma un ventrālajā tegmentālā laukā/substantia nigra. Tie ir smadzeņu lauki, kas, domājams, atbild par kognitīvo spēju, garastāvokļa un motivācijas regulāciju. Prefrontālā smadzeņu garozā, kur dopamīna D2 un D3 receptoru ekspresija ir mazāka, dopamīna transmisiju daudz vairāk kontrolē postsinaptiskie D1 receptori.
Atsauces: Adaptēts no Stahl, CNS spec. 2017;22:305-311 18; Fatemi SH. The medical basis of psychiatry. 4th edition. Sringer 2016;p93-9427
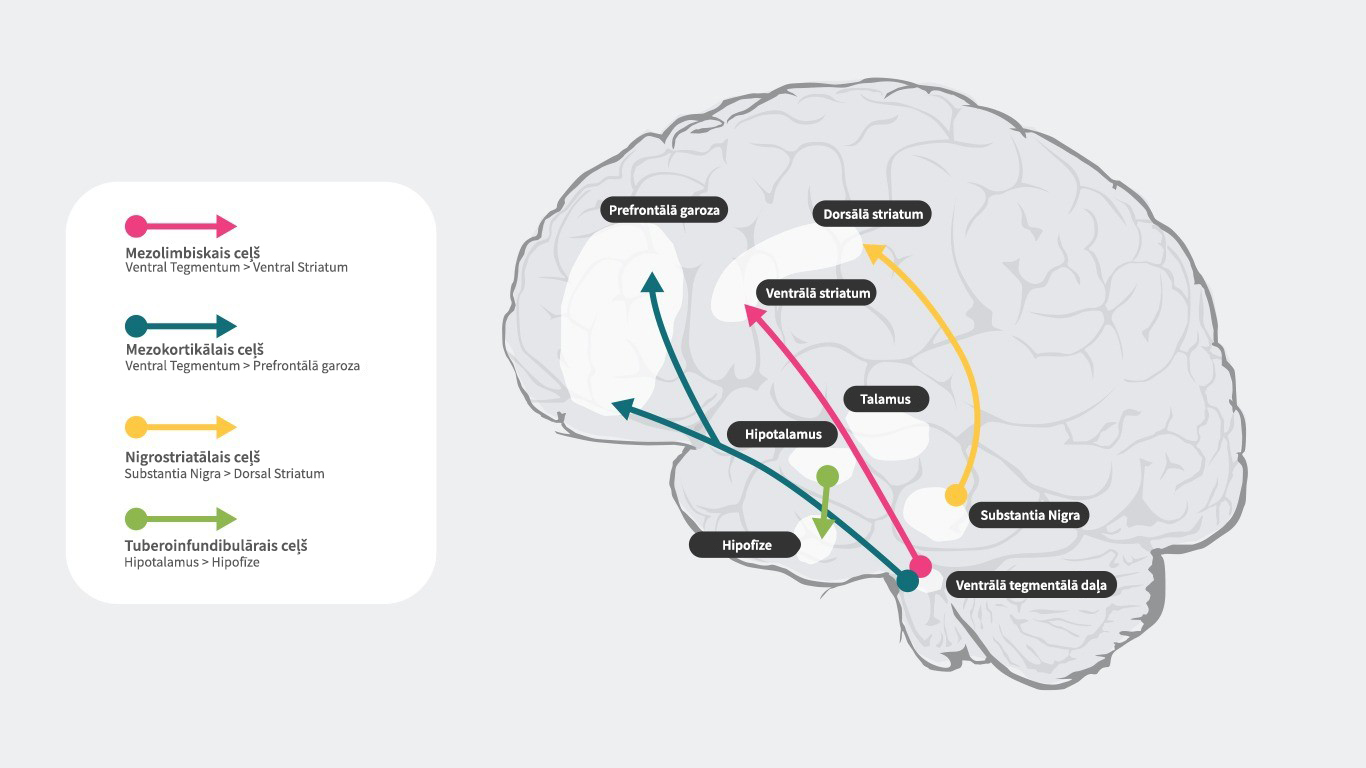
Dopamīnerģiskie ceļi
Cilvēka smadzenēs ir 4 galvenie dopamīnerģiskie ceļi: mezolimbiskais, mezokortikālais, nigrostriatālais un tuberoinfundibulārais ceļš27:
mezolimbiskais ceļš: mezolimbiskais ceļš zināms arī kā atalgojuma ceļš, pārvada dopamīnu no ventrālās tegmentālās daļas (VTA) uz striatum ventrālo daļu. Ventrālā tegmentālā daļa atrodas vidussmadzenēs, un striatum ventrālā daļa atrodas priekšējās smadzenēs un ietver gan nucleus accumbens, gan tuberculum olfactorium.
mezokortikālais ceļš: mezokortikālais ceļš, kas atbild par kognitīvajām funkcijām un emocijām, pārvada dopamīnu no ventrālās tegmentālās daļas uz prefrontālo garozu.
nigrostriatālais ceļš: nigrostriatālais ceļš atbild par mēķtiecīgu kustību veikšanu, pārvada dopamīnu no substantia nigra pars compacta (SNc), kas atrodas vidussmadzenēs, uz nucleus caudatus un putamen, kas atrodas striatum dorsālajā daļā.
tuberoinfundibulārais ceļš: tuberoinfundibulārais ceļš pārnes dopamīnu no hipotalāma infundibuārā kodola uz hipofīzi. Šis ceļš regulē hipofīzes hormonu, tostarp, prolaktīna sekrēciju.
Atsauces: Adaptēts no Fatemi SH. The medical basis of psychiatry. 4th edition. Sringer 2016;p93-9427
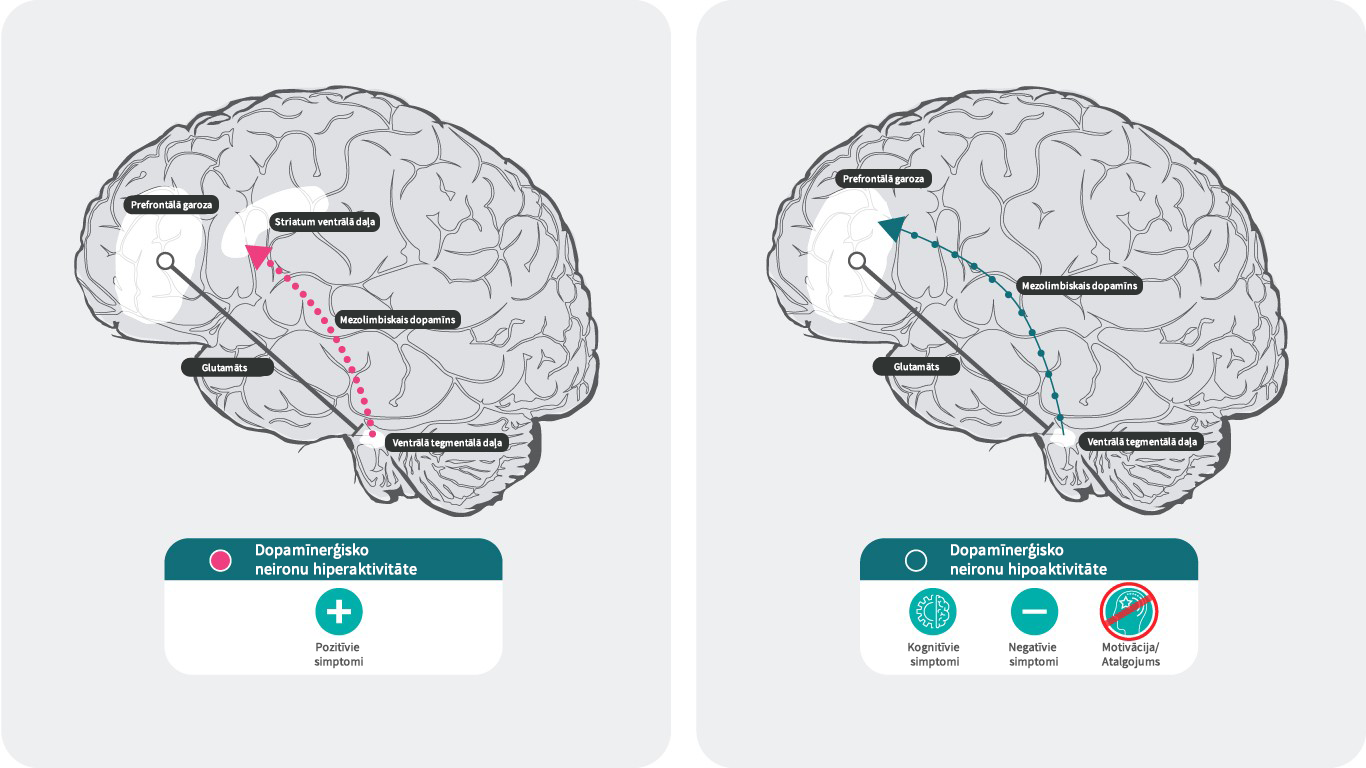
Dopamīns un šizofrēnija28,29
Šizofrēnijas dopamīna hipotēze nosaka, ka hiperaktīva dopamīna neirotransmisija subkortikālajos un limbiskajos smadzeņu reģionos ir saistīta ar šizofrēnijas pozitīvajiem simptomiem30, savukārt mezokortikālās daļas dopamīna hipofunkcionalitāte prefrontālajā smadzeņu garozā vairāk atbild par negatīvajiem un kognitīvajiem simptomiem.31,32
Atsauces: Adaptēts no Stahl SM. 4th ed. New York, NY: Cambridge University Press; 20131; Howes J Psychopharmacol. 2015 February; 29(2): 97–115.; 35. Elert E, Nature 2014. 508. s2-s329
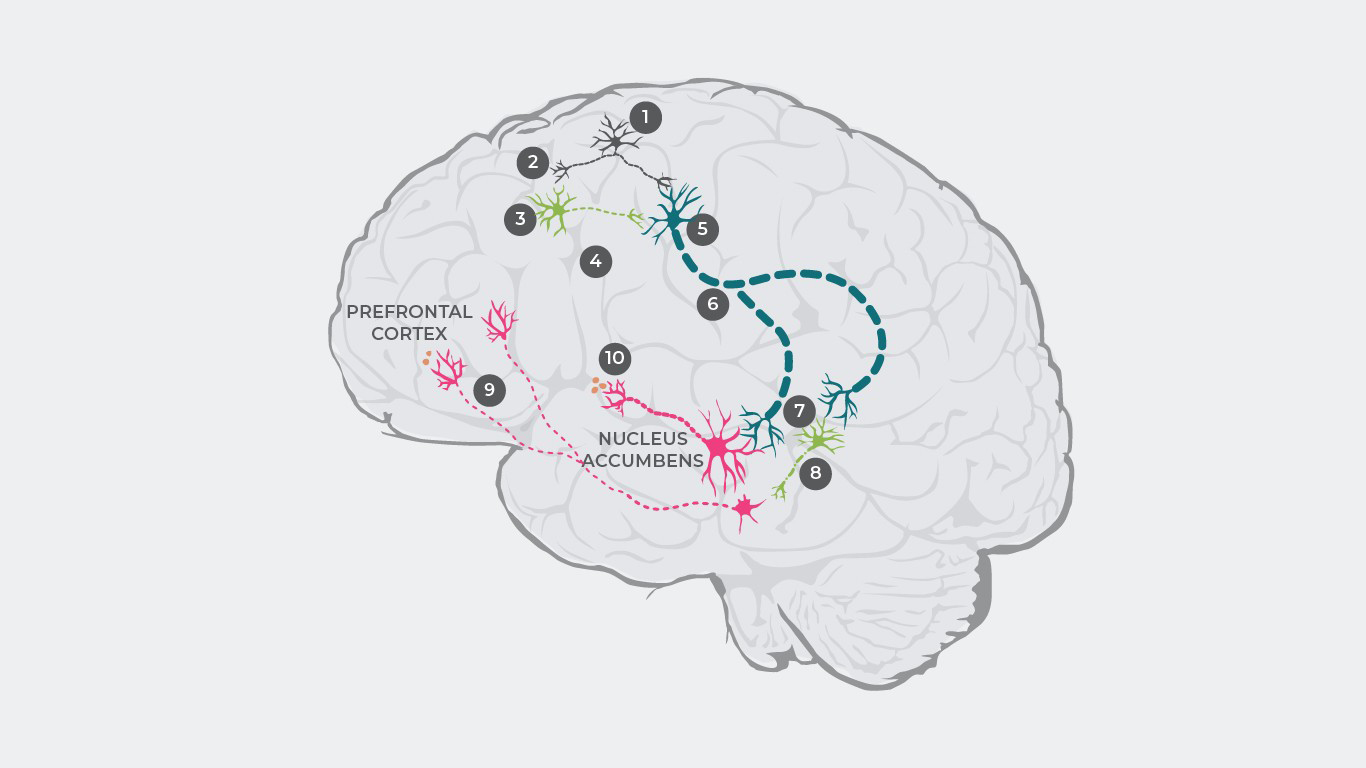
Dopamīna disregulācijas vairākas teorijas piedāvā skaidrojumu šizofrēnijas patofizioloģijai.33,34 Piemēram, kādā pētījumā apgalvots, ka šizofrēnijas patofizioloģiju galvenokārt varētu radīt glutamāta disregulācija, izjaucot dopamīna līdzsvaru.35
Šī kaskāde aizsākas ar elektrisku impulsu rašanos glutamāta neironos,1 kas izraisa glutamāta atbrīvošanos sinapsē.2
Ja nav traucējumu organisma darbībā, glutamāts piesaistās receptoriem uz inhibējošiem GABA neironiem un uzbudinošiem glutamāta neironiem. Savukārt šizofrēnijas pacientiem glutamāta saistīšanās ar GABA neironiem ir traucēta,3 kā rezultātā inhibējošie neirotransmiteri neatbrīvojas.4 Tomēr glutamāts joprojām sasaistās ar uzbudinošiem glutamāta neironiem,5 kā rezultātā pastiprināts signāls tiek raidīts uz smadzeņu stumbru.6
Attiecīgi sinapsē atbrīvojas pārāk daudz glutamāta, kas pārstimulē gan dopamīna neironus, gan citus inhibējošos GABA neironus.7
Pārstimulētie GABA neironi nomāc citu dopamīna neironu aktivitāti.8 Šis neaktīvais dopamīna neirons raida intermitētus signālus no ventrālā tegmentālā lauka uz prefrontālo smadzeņu garozu, kur atbrīvojas pārāk maz dopamīna.9 Tas izraisa hipodopamīnerģisko stāvokli mezokortikalajā sistēmā, kas, savukārt rezultējas negatīvo simptomu manifestācijā.1
Vēlāk šie pārstimulētie dopamīna neironi raida pastiprinātus signālus no ventrālā tegmentālā lauka uz striatum ventrālo daļu, izraisot pārāk lielu dopamīna atbrīvošanos,10 kas noved pie hiperdopamīnerģijas mezolimbiskajā sistēmā un izraisa pozitīvos simptomus.
Atsauces: Adaptēts no Stahl SM. 4th ed. New York, NY: Cambridge University Press; 20131; Howes J Psychopharmacol. 2015 February; 29(2): 97–11529; Elert Nature volume 508, pages S2–S3 (03 April 2014)35
Pētījumi apstiprina, ka paaugstināta dopamīna D2 receptoru neirotransmisija subkortikālajos un limbiskajos smadzeņu reģionos veicina pozitīvos simptomus.31,32 Tomēr nav skaidri izzināti mehānismi, kas tieši rada negatīvos un kognitīvos simptomus.
Patlaban tiek uzskatīts, ka samazinātu dopamīna atbrīvošanos prefrontālajā smadzeņu garozā rada presinaptiskā dopamīna D3 autoreceptoru aktivācija ventrālā tegmentālā laukā, kas saistīta ar prefrontālo smadzeņu garozu. Dopamīna receptoru apakštipu vidū, D3 receptoriem ir augstākā spēja saistīties ar dopamīnu. Atšķirībā no D1 vai D2 receptoriem, D3 receptori var tikt stimulēti pat pie zemas dopamīna atbrīvošanās, kas var “apspiest” svārstību efektu pēc straujas dopamīna fāziskas atbrīvošanās.
Šīs pavājināšanās bloķēšana inhibē dopamīna atbrīvošanos un veicina neirotransmisiju. Dopamīna koncentrācijas pieaugums var novērst hipodopamīnerģisko stāvokli aktivējot D1 receptorus prefrontālajā smadzeņu garozā, kas nav aktīvi, ja dopamīna līmenis ir zems32 un rezultēties ar negatīvo simptomu un kognitīvo spēju uzlabošanos.
Pētījumos ar dzīvnieku modeļiem, tostarp primātiem, vislabākais kognitīvo funkciju uzlabošanās efekts tika panākts, kad D1 receptora aktivitāte tika optimizēta prefrontālajā smadzeņu garozā. Pārāk liela dopamīna, kā arī pārāk zema dopamīna aktivitāte kortikālajos D1 receptoros saistīta ar kognitīvo disfunkciju. Hipotētiski, zāles, kas vai nu bloķē vai pārstimulē D1 receptorus, var izjaukt dopamīna stimulāciju un veicināt kognitīvos, negatīvos un garastāvokļa simptomus, radot līdzsvara trūkumu neirotransmisijā kortikālajās sinapsēs. Iespējams, D3 receptoru antagonisti var kavēt dopamīna atbrīvošanos un līdzsvarot kortikālo apriti, kas savukārt varētu uzlabot kognitīvo spēju, garastāvokli un negatīvos simptomus.4
Atsauces
- Stahl, S. M. Stahl’s Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. (Cambridge University Press, 2013).
- Seeman, P. Schizophrenia and dopamine receptors. Eur. Neuropsychopharmacol. 23, 999–1009 (2013).
- Kaar, S. J., Natesan, S., McCutcheon, R. & Howes, O. D. Antipsychotics: Mechanisms underlying clinical response and side-effects and novel treatment approaches based on pathophysiology. Neuropharmacology (2019). doi:10.1016/j.neuropharm.2019.107704
- Stahl, S. M. Dazzled by the dominions of dopamine: Clinical roles of D3, D2, and D1 receptors. CNS Spectr. 22, 305–311 (2017).
- Cools, R. & D’Esposito, M. Inverted-U-shaped dopamine actions on human working memory and cognitive control. Biol. Psychiatry 69, e113-125 (2011).
- Hamid, A. A. et al. Mesolimbic dopamine signals the value of work. Nat. Neurosci. 19, 117-126. (2016).
- Koob, G. F., Caine, B., Markou, A., Pulvirenti, L. & Weiss, F. Role for the mesocortical dopamine system in the motivating effects of cocaine. NIDA Res. Monogr. Ser. 145, 1-18. (1994).
- Biesdorf, C. et al. Dopamine in the nucleus accumbens core, but not shell, increases during signaled food reward and decreases during delayed extinction. Neurobiol. Learn. Mem. 123, 125–139 (2015).
- Der-Avakian, A. & Markou, A. The neurobiology of anhedonia and other reward-related deficits. Trends Neurosci. 35, 68–77 (2012).
- Leggio, G. M., Micale, V. & Drago, F. Increased sensitivity to antidepressants of D3 dopamine receptor-deficient mice in the forced swim test (FST). Eur. Neuropsychopharmacol. 18, 271–277 (2008).
- Stahl, S. M. Describing an atypical antipsychotic: receptor binding and its role in pathophysiology. Prim. Care Companion J. Clin. Psychiatry 5, 9–13 (2003).
- Plowman, E. K., Thomas, N. J. & Kleim, J. A. Striatal dopamine depletion induces forelimb motor impairments and disrupts forelimb movement representations within the motor cortex. J. Parkinsons. Dis. 1, 93–100 (2011).
- Dichter, G. S., Damiano, C. A. & Allen, J. A. Reward circuitry dysfunction in psychiatric and neurodevelopmental disorders and genetic syndromes: Animal models and clinical findings. J. Neurodev. Disord. 4, 19 (2012).
- Ashok, A. H. et al. The dopamine hypothesis of bipolar affective disorder: The state of the art and implications for treatment. Mol. Psychiatry 22, 666–679 (2017).
- Orio, L., Wee, S., Newman, A. H., Pulvirenti, L. & Koob, G. F. The dopamine D3 receptor partial agonist CJB090 and antagonist PG01037 decrease progressive ratio responding for methamphetamine in rats with extended-access. Addict. Biol. 15, 312–323 (2010).
- Volkow, N. D. et al. Methylphenidate-elicited dopamine increases in ventral striatum are associated with long-term symptom improvement in adults with attention deficit hyperactivity disorder. J. Neurosci. 32, 841–849 (2012).
- Beaulieu, J. M., Espinoza, S. & Gainetdinov, R. R. Dopamine receptors – IUPHAR review 13. Br. J. Pharmacol. 172, 1–23 (2015).
- Sunahara, R. K. et al. Cloning of the gene for a human dopamine D5 receptor with higher affinity for dopamine than D1. Nature 350, 614–619 (1991).
- Toll, L. et al. Standard binding and functional assays related to medications development division testing for potential cocaine and opiate narcotic treatment medications. NIDA Res. Monogr 178, 440–466 (1998).
- Michaelides, M. R. et al. (5aR, 11bS)-4,5,5a,6,7, 11b-hexahydro-2-propyl-3-thia-5-azacyclopent-1-ena[c]-phenanthrene-9,10-diol (A-86929): A potent and selective dopamine D1 agonist that maintains behavioral efficacy following repeated administration and characterization of its dia. J. Med. Chem. 38, 3445–3447 (1995).
- Tallman, J. F. et al. Ngd 94-1 – identification of a noval, high-affinity antagonist at the human dopamine D-4 receptor 1. J. Pharmacol Exp Ther 282, 1011–1019 (1997).
- Stahl, S. M. Mechanism of action of cariprazine. CNS Spectr. 21, 123–127 (2016).
- Gurevich, E. V. & Joyce, J. N. Distribution of dopamine D3 receptor expressing neurons in the human forebrain comparison with D2 receptor expressing neurons. Neuropsychopharmacology 20, 60–80 (1999).
- Mengod, G. et al. Visualization of dopamine D1, D2 and D3 receptor mRNA’s in human and rat brain. Neurochem. Int. 20, Suppl:33S-43S (1992).
- Meador-Woodruff, J. H. et al. Dopamine receptor mRNA expression in human striatum and neocortex. Neuropsychopharmacology 15, 17–29 (1996).
- Fuxe, K. et al. Dopaminergic Systems in the Brain and Pituitary. in Basic and Clinical Aspects of Neuroscience (eds. Flückinger, E., Müller, E. E. & Thorner, M. O.) (Springer, 1985). doi:10.1007/978-3-642-69948-1_2
- Fatemi, S. H. & Clayton, P. J. The medical basis of psychiatry: Fourth edition. The Medical Basis of Psychiatry: Fourth Edition (2016). doi:10.1007/978-1-4939-2528-5
- Howes, O. D. & Kapur, S. The dopamine hypothesis of schizophrenia: Version III – The final common pathway. Schizophr. Bull. 35, 549–562 (2009).
- Howes, O., McCutcheon, R. & Stone, J. Glutamate and dopamine in schizophrenia: An update for the 21st century. J. Psychopharmacol. 29, 97–115 (2015).
- Desbonnet, L. Modeling the Psychopathological Dimensions of Schizophrenia. in Handbook of Behavioural Neuroscience 267–284 (2016).
- Toda, M. & Abi-Dargham, A. Dopamine hypothesis of schizophrenia: Making sense of it all. Curr. Psychiatry Rep. 9, 329–336 (2007).
- Stahl, S. M. Drugs for psychosis and mood: Unique actions at D3, D2, and D1 dopamine receptor subtypes. CNS Spectr. 22, 375–384 (2017).
- Grace, A. A. & Gomes, F. V. The circuitry of dopamine system regulation and its disruption in schizophrenia: Insights into treatment and prevention. Schizophr. Bull. 45, 148–157 (2019).
- Grace, A. A. Dysregulation of the dopamine system in the pathophysiology of schizophrenia and depression. Nat. Rev. Neurosci. 17, 524–532 (2016).
- Elert, E. Aetiology: Searching for schizophrenia’s roots. Nature 508, S2-3 (2014).
CNS Spectrums
Dazzled by the dominions of dopamine: clinical roles of D3, D2, and D1 receptors.
ANTIPSIHOTISKIE MEDIKAMENTI, CITĀDS DARBĪBAS MEHĀNISMS?ANTIPSIHOTISKIE MEDIKAMENTI, CITĀDS DARBĪBAS MEHĀNISMS?
Tipisko antipsihotisko medikamentu klīniskā efektivitāte, iespējams, ir atkarīga no to augstās piesaistīšanās spējas D2 receptoriem un sekojošas Tipisko antipsihotisko medikamentu klīniskā efektivitāte, iespējams, ir atkarīga no to augstās piesaistīšanās spējas D2 receptoriem un sekojošas
vēl…KĀ DARBOJAS REAGILA?KĀ DARBOJAS REAGILA?
Kariprazīnam ir augsta spēja saistīties ar dopamīna D3 un D2 receptoriem, ka arī ar serotonīna 5‑HT2B un 5‑HT1A Kariprazīnam ir augsta spēja saistīties ar dopamīna D3 un D2 receptoriem, ka arī ar serotonīna 5‑HT2B un 5‑HT1A
vēl…